Detection rates and high concentration of herpesvirus (Orthoherpesviridae) DNA in autopsy materials from patients with COVID-19 fatal outcome
- Authors: Yurlov K.I.1, Yakushina S.A.1,2, Fedorova N.E.1, Kisteneva L.B.1,2, Kelly E.I.2, Kanibolotsky A.A.3,4, Ivkin Y.N.3,4, Antipiat N.A.2, Turin I.N.2, Larichev V.F.1, Demidova N.A.1, Lesnova E.I.1, Klimova R.R.1, Masalova O.V.1, Kushch A.A.1
-
Affiliations:
- National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
- Department of Health, Moscow Infectious Clinical Hospital No. 1
- Sklifosovsky Research Institute For Emergency Medicine, «Sklifosovsky Institute»
- Research Institute for Healthcare and Medical Management of Moscow Healthcare Department
- Issue: Vol 69, No 2 (2024)
- Pages: 134-150
- Section: ORIGINAL RESEARCHES
- URL: https://ogarev-online.ru/0507-4088/article/view/256875
- DOI: https://doi.org/10.36233/0507-4088-215
- EDN: https://elibrary.ru/jxmqzh
- ID: 256875
Cite item
Full Text
Abstract
Introduction. SARS-CoV-2 infection causes immune disorders that create conditions for the reactivation of human herpesviruses (HHVs). However, the estimates of the HHVs effect on the course and outcome of COVID-19 are ambiguous.
Аim – to study the possible relationship between the HHV reactivation and the adverse outcome of COVID-19.
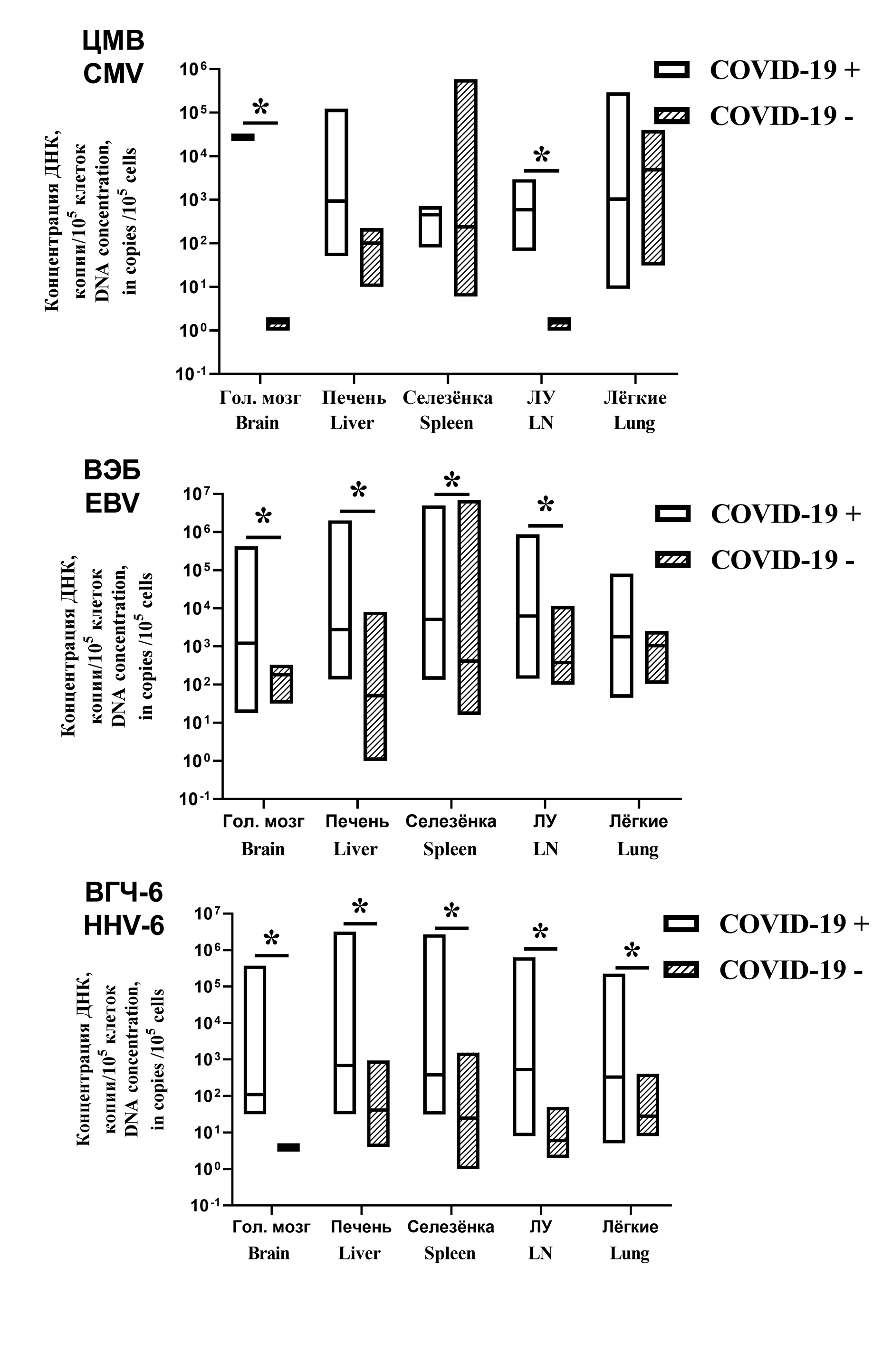
Materials and methods. Postmortem samples from the brain, liver, spleen, lymph nodes and lungs were obtained from 59 patients treated at the Moscow Infectious Diseases Hospital No.1 in 2021–2023. The group 1 comprised 39 patients with fatal COVID-19; group 2 (comparison group) included 20 patients not infected with SARS-CoV-2 who died from various somatic diseases. HHV DNA and SARS-CoV-2 RNA were determined by PCR.
Results. HHV DNA was found in autopsy samples from all patients. In group 1, EBV was most often detected in lymph nodes (94%), HHV-6 in liver (68%), CMV in lymph nodes (18%), HSV in brain (16%), VZV in lung and spleen (3% each). The detection rates of HHVs in both groups was similar. Important differences were found in viral load. In patients with COVID-19, the number of samples containing more than 1,000 copies of HHV DNA per 100,000 cells was 52.4%, in the comparison group – 16.6% (p < 0.002). An association has been established between the reactivation of HSV and HHV-6 and the severity of lung damage. Reactivation of EBV correlated with increased levels of liver enzymes.
Conclusion. Reactivation of HHVs in patients with fatal COVID-19 was associated with severe lung and liver damages, which indicates a link between HHV reactivation and COVID-19 deaths.
Full Text
##article.viewOnOriginalSite##About the authors
Kirill I. Yurlov
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: kir34292@yandex.ru
ORCID iD: 0000-0002-4694-2445
SPIN-code: 1767-5652
Researcher
Russian Federation, 123098, MoscowSofia A. Yakushina
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation; Department of Health, Moscow Infectious Clinical Hospital No. 1
Email: sofia.iakushina@gmail.com
ORCID iD: 0000-0003-0507-0174
SPIN-code: 9585-8019
junior researcher, infectious disease physician
Russian Federation, 125367, Moscow; 123098, MoscowNatalya E. Fedorova
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: ninani@mail.ru
ORCID iD: 0000-0001-8466-7993
SPIN-code: 1090-2763
Senior Researcher
Russian Federation, 123098, MoscowLidiia B. Kisteneva
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation; Department of Health, Moscow Infectious Clinical Hospital No. 1
Email: lidia.kisteneva@gmail.com
ORCID iD: 0000-0001-7336-409X
SPIN-code: 9205-3670
Dr. Sci. (Medicine), Leading Researcher
Russian Federation, 125367, Moscow; 123098, MoscowElena I. Kelly
Department of Health, Moscow Infectious Clinical Hospital No. 1
Email: ekelly@yandex.ru
ORCID iD: 0009-0000-2718-9462
specialist in pathological anatomy
Russian Federation, 125367, MoscowAlexander A. Kanibolotsky
Sklifosovsky Research Institute For Emergency Medicine, «Sklifosovsky Institute»; Research Institute for Healthcare and Medical Management of Moscow Healthcare Department
Email: dr.kaa@mail.ru
ORCID iD: 0000-0001-6123-8387
SPIN-code: 3976-1662
Scopus Author ID: 57223849355
ResearcherId: HLG-3242-2023
Candidate of Medical Sciences, Associate Professor, Head of the Pathoanatomical Department, Head of the Department of Medical Education for Pathological Anatomy of the Research Institute of Healthcare Organization and Medical Management of the Moscow Department of Health
Russian Federation, 129090, Moscow; 115184, MoscowYevgeniy N. Ivkin
Sklifosovsky Research Institute For Emergency Medicine, «Sklifosovsky Institute»; Research Institute for Healthcare and Medical Management of Moscow Healthcare Department
Email: evgenuivkin@rambler.ru
ORCID iD: 0009-0004-2609-1788
pathologist doctor Research Institute of Emergency Medicine, specialist in pathological anatomy Department of Medical Education for Pathological Anatomy
Russian Federation, 129090, Moscow; 115184, MoscowNatalia A. Antipiat
Department of Health, Moscow Infectious Clinical Hospital No. 1
Author for correspondence.
Email: natadog70@bk.ru
ORCID iD: 0000-0001-8578-2838
deputy chief physician Infectious Diseases
Russian Federation, 125367, MoscowIgor N. Turin
Department of Health, Moscow Infectious Clinical Hospital No. 1
Email: tyurin.dti@yandex.ru
ORCID iD: 0000-0002-5696-1586
SPIN-code: 6755-0576
chief physician Infectious Diseases
Russian Federation, 125367, MoscowVictor F. Larichev
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: vlaritchev@mail.ru
ORCID iD: 0000-0001-8262-5650
SPIN-code: 5826-1430
Dr. Sci. (Medicine), Leading Researcher
Russian Federation, 123098, MoscowNatalia A. Demidova
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: ailande@yandex.ru
ORCID iD: 0000-0003-1961-9789
SPIN-code: 8759-0277
Researcher
Russian Federation, 123098, MoscowEkaterina I. Lesnova
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: wolf252006@yandex.ru
ORCID iD: 0000-0002-2801-6843
SPIN-code: 9901-8607
Senior Researcher
Russian Federation, 123098, MoscowRegina R. Klimova
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: rklimova@yandex.ru
ORCID iD: 0000-0002-4147-8444
SPIN-code: 8286-6108
Researcher, Gamaleya NRC of Epidemiology and Microbiology
Russian Federation, 123098, MoscowOlga V. Masalova
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: ol.mas@mail.ru
ORCID iD: 0000-0001-5571-5669
SPIN-code: 7210-0870
Dr. Sci. (Biology), Leading Researcher, Head of the Laboratory
Russian Federation, 123098, MoscowAlla A. Kushch
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: vitallku@mail.ru
ORCID iD: 0000-0002-3396-5533
SPIN-code: 6964-1715
Professor, Dr. Sci. (Biology), Leading Researcher
Russian Federation, 123098, MoscowReferences
- Carvalho J.L., Silva-Carvalho A.E., Garcez E.M., Saldanha-Araujo F. Commentary: mesenchymal stem cells: a new piece in the puzzle of COVID-19 treatment. Front. Immunol. 2021; 12: 682195. https://doi.org/10.3389/fimmu.2021.682195
- Rabi F.A., Al Zoubi M.S., Kasasbeh G.A., Salameh D.M., Al-Nasser A.D. SARS-CoV-2 and coronavirus disease 2019: what we know so far. Pathogens. 2020; 9(3): 231. https://doi.org/10.3390/pathogens9030231
- Blanco-Melo D., Nilsson-Payant B.E., Liu W.C., Uhl S., Hoagland D., Møller R., et al. Imbalanced host response to SARS-CoV-2 drives development of COVID-19. Cell. 2020; 181(5): 1036–45.e9. https://doi.org/10.1016/j.cell.2020.04.026
- Montazersaheb S., Hosseiniyan Khatibi S.M., Hejazi M.S., Tarhriz V., Farjami A., Ghasemian Sorbeni F., et al. COVID-19 infection: an overview on cytokine storm and related interventions. Virol. J. 2022; 19(1): 92. https://doi.org/10.1186/s12985-022-01814-1
- Lowery S.A., Sariol A., Perlman S. Innate immune and inflammatory responses to SARS-CoV-2: Implications for COVID-19. Cell Host Microbe. 2021; 29(7): 1052–62. https://doi.org/10.1016/j.chom.2021.05.004
- Liu L., Wei Q., Lin Q., Fang J., Wang H., Kwok H., et al. Anti-spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS-CoV infection. JCI Insight. 2019; 4(4): e123158. https://doi.org/10.1172/jci.insight.123158
- Zheng M., Gao Y., Wang G., Song G., Liu S., Sun D., et al. Functional exhaustion of antiviral lymphocytes in COVID-19 patients. Cell Mol. Immunol. 2020; 17(5): 533–5. https://doi.org/10.1038/s41423-020-0402-2
- Wang Y., Zheng J., Islam M.S., Yang Y., Hu Y., Chen X. The role of CD4+FoxP3+ regulatory T cells in the immunopathogenesis of COVID-19: implications for treatment. Int. J. Biol. Sci. 2021; 17(6): 1507–20. https://doi.org/10.7150/ijbs.59534
- Thorne L.G., Reuschl A.K., Zuliani-Alvarez L., Whelan M.V.X., Turner J., Noursadeghi M., et al. SARS-CoV-2 sensing by RIG-I and MDA5 links epithelial infection to macrophage inflammation. EMBO J. 2021; 40(15): e107826. https://doi.org/10.15252/embj.2021107826
- Cantan B., Luyt C.E., Martin-Loeches I. Influenza infections and emergent viral infections in intensive care unit. Semin. Respir. Crit. Care Med. 2019; 40(4): 488–97. https://doi.org/10.1055/s-0039-1693497
- Talan L., Akdemir Kalkan İ., Altıntaş N.D., Yörük F. Cytomegalovirus reactivation in critically-ill COVID-19 patients. Balkan Med. J. 2022; 39(4): 301–2. https://doi.org/10.4274/balkanmedj.galenos.2022.2022-2-2
- Amaral P.H., Ferreira B.M., Roll S., Neves P.D., Pivetta L.G., Mohrbacher S., et al. COVID-19 and cytomegalovirus co-infection: a challenging case of a critically ill patient with gastrointestinal symptoms. Eur. J. Case Rep. Intern. Med. 2020; 7(10): 001911. https://doi.org/10.12890/2020_001911
- Bernal K.D.E., Whitehurst C.B. Incidence of Epstein-Barr virus reactivation is elevated in COVID-19 patients. Virus Res. 2023; 334: 199157. https://doi.org/10.1016/j.virusres.2023.199157
- Manoharan S., Ying L.Y. Epstein Barr virus reactivation during COVID-19 hospitalization significantly increased mortality/death in SARS-CoV-2(+)/EBV(+) than SARS-CoV-2(+)/EBV(-) patients: a comparative meta-analysis. Int. J. Clin. Pract. 2023; 2023: 1068000. https://doi.org/10.1155/2023/1068000
- Berzero G., Campanini G., Vegezzi E., Paoletti M., Pichiecchio A., Simoncelli A.M., et al. Human herpesvirus 6 encephalitis in immunocompetent and immunocompromised hosts. Neurol. Neuroimmunol. Neuroinflamm. 2021; 8(2): e942. https://doi.org/10.1212/NXI.0000000000000942
- Di Nora A., Pizzo F., Costanza G., Ruggieri M., Falsaperla R. Human herpes 6 encephalitis in co-infection with COVID-19. Acta Neurol. Belg. 2023; 123(2): 687–8. https://doi.org/10.1007/s13760-022-01961-w
- Katz J., Yue S., Xue W. Herpes simplex and herpes zoster viruses in COVID-19 patients. Ir. J. Med. Sci. 2022; 191(3): 1093–7. https://doi.org/10.1007/s11845-021-02714-z
- Shafiee A., Teymouri Athar M.M., Amini M.J., Hajishah H., Siahvoshi S., Jalali M., et al. Reactivation of herpesviruses during COVID-19: A systematic review and meta-analysis. Rev. Med. Virol. 2023; 33(3): e2437. https://doi.org/10.1002/rmv.2437
- Nakashima J., Kadomatsu Y., Itagaki S., Otani T., Kiriu T., Matsunaga A., et al. A case-series of six autopsy cases of COVID-19 including three cases of cytomegalovirus coinfection. Pathol. Int. 2022; 72(6): 358–60. https://doi.org/10.1111/pin.13230
- Haslbauer J.D., Zinner C., Stalder A.K., Schneeberger J., Menter T., Bassetti S., et al. Vascular damage, thromboinflammation, plasmablast activation, T-cell dysregulation and pathological histiocytic response in pulmonary draining lymph nodes of COVID-19. Front. Immunol. 2021; 12: 763098. https://doi.org/10.3389/fimmu.2021.763098
- Iqbal B., Rahman N.M., Hallifax R.J. COVID-19-related pleural diseases. Semin. Respir. Crit. Care Med. 2023; 44(4): 437–46. https://doi.org/10.1055/s-0043-1769616
- Paolucci S., Cassaniti I., Novazzi F., Fiorina L., Piralla A., Comolli G., et al. EBV DNA increase in COVID-19 patients with impaired lymphocyte subpopulation count. Int. J. Infect. Dis. 2021; 104: 315–9. https://doi.org/10.1016/j.ijid.2020.12.051
- Simonnet A., Engelmann I., Moreau A.S., Garcia B., Six S., El Kalioubie A., et al. High incidence of Epstein-Barr virus, cytomegalovirus, and human-herpes virus-6 reactivations in critically ill patients with COVID-19. Infect. Dis. Now. 2021; 51(3): 296–9. https://doi.org/10.1016/j.idnow.2021.01.005
- Chen T., Song J., Liu H., Zheng H., Chen C. Positive Epstein-Barr virus detection in coronavirus disease 2019 (COVID-19) patients. Sci. Rep. 2021; 11(1): 10902. https://doi.org/10.1038/s41598-021-90351-y
- Meng M., Zhang S., Dong X., Sun W., Deng Y., Li W., et al. COVID-19 associated EBV reactivation and effects of ganciclovir treatment. Immun. Inflamm. Dis. 2022; 10(4): e597. https://doi.org/10.1002/iid3.597
- Giacconi R., Cardelli M., Piacenza F., Pierpaoli E., Farnocchia E., Di Rosa M., et al. Effect of cytomegalovirus reactivation on inflammatory status and mortality of older COVID-19 patients. Int. J. Mol. Sci. 2023; 24(7): 6832. https://doi.org/10.3390/ijms24076832
- Pérez-Granda M.J., Catalán P., Muñoz P., Aldámiz T., Barrios J.C., Ramírez C., et al. Cytomegalovirus reactivation in patients diagnosed with severe COVID-19: A point prevalence study in a general hospital. Rev. Esp. Quimioter. 2023; 36(1): 45–51. https://doi.org/10.37201/req/068.2022
- Pérez-Pedrero Sánchez-Belmonte M.J., Sánchez-Casado M., Moran Gallego F.J., Piza Pinilla R., Gomez Hernando C., Paredes Borrachero I. Herpes simplex virus type 1 (HSV-1) over-infection in patients with acute respiratory distress syndrome secondary to COVID-19 pneumonia: Impact on mortality. Med. Clin. (Engl. Ed). 2023; 160(2): 66–70. https://doi.org/10.1016/j.medcle.2022.04.019
- Yang X., Yu Y., Xu J., Shu H., Xia J., Liu H., et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir. Med. 2020; 8(5): 475–81. https://doi.org/10.1016/S2213-2600(20)30079-5
- Li Q., Chen Z., Zhou X., Li G., Zhang C., Yang Y. Ferroptosis and multi-organ complications in COVID-19: mechanisms and potential therapies. Front. Genet. 2023; 14: 1187985. https://doi.org/10.3389/fgene.2023.1187985
- Gabrielli L., Balboni A., Borgatti E.C., Virgili G., Petrisli E., Cantiani A., et al. Inherited chromosomally integrated human herpesvirus 6: laboratory and clinical features. Microorganisms. 2023; 11(3): 548. https://doi.org/10.3390/microorganisms11030548
- Qiu M.Z., He C.Y., Lu S.X., Guan W.L., Wang F., Wang X.J., et al. Prospective observation: Clinical utility of plasma Epstein-Barr virus DNA load in EBV-associated gastric carcinoma patients. Int. J. Cancer. 2020; 146(1): 272–80. https://doi.org/10.1002/ijc.32490
- Solomay T.V., Semenenko T.A., Filatov N.N., Vedunova S.L., Lavrov V.F., Smirnova D.I., et al. Reactivation of Epstein-Barr virus (Herpesviridae: Lymphocryptovirus, HHV-4) infection during Covid-19: epidemiological features. Voprosy virusologii. 2021; 66(2): 152–61. https://doi.org/10.36233/0507-4088-40 https://elibrary.ru/nhbzyr (in Russian)
- Roncati L., Manenti A., Fabbiani L., Malagoli C., Nasillo V., Lusenti B., et al. HSV1 viremia with fulminant hepatitis as opportunistic sequela in severe COVID-19. Ann. Hematol. 2022; 101(1): 229–31. https://doi.org/10.1007/s00277-021-04417-y
- Silaghi-Dumitrescu R., Patrascu I., Lehene M., Bercea I. Comorbidities of COVID-19 patients. Medicina (Kaunas). 2023; 59(8): 1393. https://doi.org/10.3390/medicina59081393
- Nikitskaya E., Lebedeva A., Ivanova O., Maryukhnich E., Shpektor A., Grivel J.C., et al. Cytomegalovirus-productive infection is associated with acute coronary syndrome. J. Am. Heart Assoc. 2016; 5(8): e003759. https://doi.org/10.1161/JAHA.116.003759
- Chimenti C., Verardo R., Grande C., Francone M., Frustaci A. Infarct-like myocarditis with coronary vasculitis and aneurysm formation caused by Epstein-Barr virus infection. ESC Heart Fail. 2020; 7(3): 938–41. https://doi.org/10.1002/ehf2.12611
- Chen X., Li Y., Deng L., Wang L., Zhong W., Hong J., et al. Cardiovascular involvement in Epstein-Barr virus infection. Front. Immunol. 2023; 14: 1188330. https://doi.org/10.3389/fimmu.2023.1188330
- Prasoppokakorn T., Assanasen T., Chantranuwatana P., Suankratay C. EBV-associated lymphoid interstitial pneumonia in IBD patient: Case report and literature review. Respir. Med. Case Rep. 2020; 30: 101059. https://doi.org/10.1016/j.rmcr.2020.101059
- Yurlov K.I., Masalova O.V., Kisteneva L.B., Khlopova I.N., Samokhvalov E.I., Malinovskaya V.V., et al. Human herpesviruses increase the severity of hepatitis. Biology (Basel). 2021; 10(6): 483. https://doi.org/10.3390/biology10060483
- Lin J., Zheng Y., Zhao N., Cui F., Wu S. Herpesvirus latent infection promotes stroke via activating the OTUD1/NF-κB signaling pathway. Aging (Albany NY). 2023; 15(17): 8976–92. https://doi.org/10.18632/aging.205011.
- Verma D., Church T.M., Swaminathan S. Epstein-Barr virus lytic replication induces ACE2 expression and enhances SARS-CoV-2 pseudotyped virus entry in epithelial cells. J. Virol. 2021; 95(13): e0019221. https://doi.org/10.1128/JVI.00192-21
- Perera M.R., Greenwood E.J.D., Crozier T.W.M., Elder E.G., Schmitt J., Crump C.M., et al. Human cytomegalovirus infection of epithelial cells increases SARS-CoV-2 superinfection by upregulating the ACE2 receptor. J. Infect. Dis. 2023; 227(4): 543–53. https://doi.org/10.1093/infdis/jiac452
- Yu X., Li L., Chan M.T.V., Wu W.K.K. Bioinformatic analyses suggest augmented interleukin-17 signaling as the mechanism of COVID-19-associated herpes zoster. Environ. Sci. Pollut. Res. Int. 2021; 28(46): 65769–75. https://doi.org/10.1007/s11356-021-15567-x
- Naendrup J.H., Garcia Borrega J., Eichenauer D.A., Shimabukuro-Vornhagen A., Kochanek M., Böll B. Reactivation of EBV and CMV in severe COVID-19-epiphenomena or trigger of hyperinflammation in need of treatment? A large case series of critically ill patients. J. Intensive Care Med. 2022; 37(9): 1152–8. https://doi.org/10.1177/08850666211053990
- Yang E.V., Webster Marketon J.I., Chen M., Lo K.W., Kim S.J., Glaser R. Glucocorticoids activate Epstein Barr virus lytic replication through the upregulation of immediate early BZLF1 gene expression. Brain Behav. Immun. 2010; 24(7): 1089–96. https://doi.org/10.1016/j.bbi.2010.04.013
Supplementary files