Изучение противовирусной активности жидких сред для хранения роговицы в отношении вируса простого герпеса in vitro
- Авторы: Алимбарова Л.М.1, Керимов Т.З.2, Борзенок С.А.3
-
Учреждения:
- ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почётного академика Н.Ф. Гамалеи» Минздрава России
- ФГБОУ ВО «Московский государственный медико-стоматологический университет имени А.И. Евдокимова» Минздрава России
- ФГАУ «Национальный медицинский исследовательский центр «Межотраслевой научно-технический комплекс «Микрохирургия глаза» имени академика С.Н. Фёдорова» Минздрава России
- Выпуск: Том 65, № 4 (2020)
- Страницы: 228-236
- Раздел: В ПОМОЩЬ ВИРУСОЛОГУ
- URL: https://ogarev-online.ru/0507-4088/article/view/118144
- DOI: https://doi.org/10.36233/0507-4088-2020-65-4-228-236
- ID: 118144
Цитировать
Полный текст
Аннотация
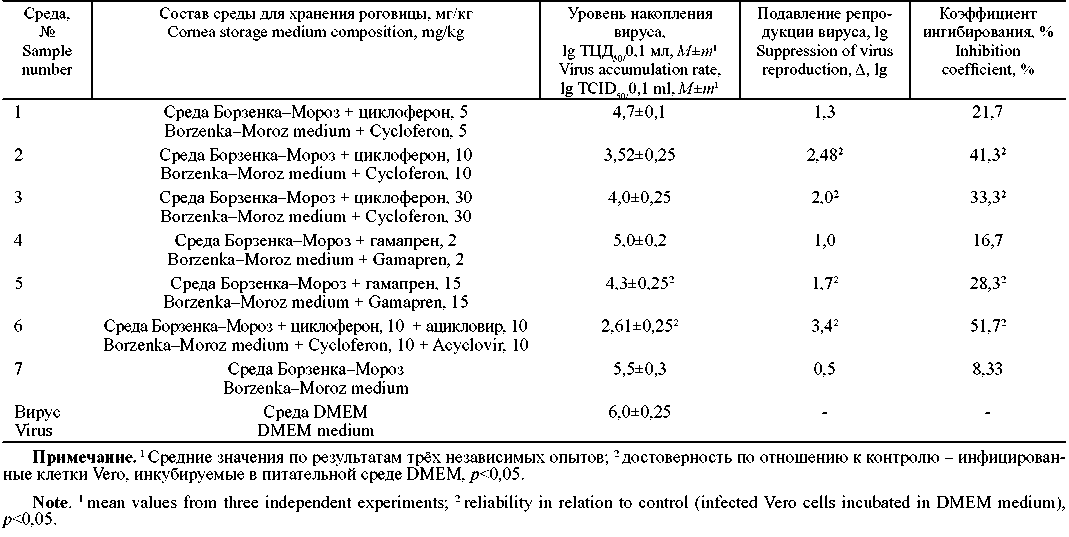
Цель исследования - изучить противовирусную активность 7 образцов жидкой среды для хранения роговицы на модели герпесвирусной инфекции in vitro.
Материал и методы. Изучена противовирусная активность 7 образцов жидкой среды для хранения роговицы (ОСХР) на модели герпесвирусной инфекции, обусловленной вирусом простого герпеса 1-го типа (ВПГ-1), штамм ЕС, в культуре клеток Vero с использованием вирусологического и статистического методов исследования.
Результаты и обсуждение. Показано, что все исследуемые образцы среды для хранения роговицы, в том числе и базовая среда Борзенка-Мороз, не оказывают цитотоксического действия на культуру клеток Vero. Установлено, что 4 из 7 образцов жидкой среды для хранения роговицы обладают достоверной противовирусной активностью в отношении ВПГ-1 при использовании по терапевтической (через 1 ч после инфицирования) и по профилактической (за 2 ч до инфицирования) схемам. Противовирусная активность установлена у 2 образцов, содержащих индуктор интерферона циклоферон в концентрации 10 и 30 мг/кг (ОСХР 2, 3 соответственно); у образца, содержащего индуктор интерферона гамапрен 15 мг/кг (ОСХР 5), и у образца, содержащего комбинацию препаратов: циклоферон 10 мг/кг и ациклический аналог нуклеозида - ацикловир 10 мг/кг (ОСХР 6). Максимальный статистически достоверный ингибиторный эффект по отношению к ВПГ-1 по результатам двух схем испытаний был выявлен у ОСХР 6, содержащего комбинацию препаратов. На фоне его применения инфекционная активность тест-вируса снижалась в среднем на 3,2 lg, коэффициент ингибиции составил 54,5%.
Заключение. Результаты исследования свидетельствуют о перспективности использования образцов противовирусных сред для хранения донорских роговиц (образцы 2, 3, 5 и 6) с целью повышения эффективности кератопластики у больных офтальмогерпесом.
Полный текст
Открыть статью на сайте журналаОб авторах
Л. М. Алимбарова
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почётного академика Н.Ф. Гамалеи» Минздрава России
Автор, ответственный за переписку.
Email: virology@mail.ru
ORCID iD: 0000-0002-8972-3111
Алимбарова Людмила Михайловна – кандидат медицинских наук, доцент, ведущий научный сотрудник.
123098, Москва
РоссияТ. З. Керимов
ФГБОУ ВО «Московский государственный медико-стоматологический университет имени А.И. Евдокимова» Минздрава России
ORCID iD: 0000-0001-8967-6370
Керимов Тимур Захирович – аспирант кафедры глазных болезней.
127473, Москва РоссияС. А. Борзенок
ФГАУ «Национальный медицинский исследовательский центр «Межотраслевой научно-технический комплекс «Микрохирургия глаза» имени академика С.Н. Фёдорова» Минздрава России
ORCID iD: 0000-0001-9160-6240
Борзенок Сергей Анатольевич – акад. РАЕН, доктор медицинских наук, профессор кафедры глазных болезней МГМСУ им. А.И. Евдокимова; руководитель Центра фундаментальных и прикладных медико-биологических проблем НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова.
127486, Москва
РоссияСписок литературы
- Исаков В.А., ред. Герпесвирусные инфекции человека: руководство для врачей. СПб.: СпецЛит; 2013.
- Resnikoff S., Pascolini D., Etya’ale D., Kocur I., Pararajasegaram R., Pokharel G.P., et al. Global data on visual impairment in the year 2002. Bull. WorldHealth Organ. 2004; 82(11): 844-51.
- Каспаров А.А. Офтальмогерпес. М.: Медицина; 1994.
- Amiri F., Ghiyasvandian S., Navab E., Zakerimoghadam M. Corneal transplantation: A new view of life. Electron. Physician. 2017; 9(4): 4055-63. DOI: http://doi.org/10.19082/4055
- Spadea L., De Rosa V Current techniques of lamellar keratoplasty for keratoconus. Saudi Med. J. 2016; 37(2): 127-36. DOI: http://doi.org/10.15537/smj.2016.2.12985
- Rahman I., Carley F., Hillarby C., Brahma A., Tullo A.B. Penetrating keratoplasty: indications, outcomes, and complications. Eye (bond). 2009; 23(6): 1288-94. DOI: http://doi.org/10.1038/eye.2008.305
- Борзенок С.А. Медико-технологические и методологические основы эффективной деятельности глазных тканевых банков России в обеспечении операций по сквозной трансплантации роговицы: Дисс. ... д-ра мед. наук. М.; 2008.
- Кагушева А.Э. Прогнозирование, профилактика и лечение персистирующих эрозий и язв трансплантата роговицы при сквозной кератопластике высокого риска: Дисс. ... кандидат медицинских наук. М.; 2013.
- Борзенок С.А., Ролик О.И., Онищенко Н.А., Комах Ю.А. Методы консервации донорских роговиц и применение гомологичных клеточных пептидов. Офтальмология. 2011; (4): 75-8.
- Armitage W.J. Preservation of human cornea. Transfus. Med. Hemother. 2011; 38(2): 143-7. DOI: http://doi.org/10.1159/000326632
- Керимов Т.З., Борзенок С.А., Гаврилова Н.А., Тонаева Х.Д. Герпесвирусная инфекция трансплантата роговицы: подходы к вирусной деконтаминации на этапе консервации. Практическая медицина. 2018; 16(3): 89-92.
- Миронкова Е.А., Макаров П.В., Слепова О.С., Гундорова P.A., Кугушева A3., Демкин В.В. и др. Инфицированность донорского материала вирусами группы герпеса как возможная причина развития болезни трансплантата при сквозной кератопластике. Вестник трансплантологии и искусственных органов. 2012; 14(4): 48-51. DOI: http://doi.org/10.15825/1995-1191-2012-4-48-51
- Shimomura Y., Deai T., Fukuda M., Higaki S., Hooper L.C., Hayashi K. Corneal buttons obtained from patients with HSK harbor high copy numbers of the HSV genome. Cornea. 2007; 26(2): 190-3. DOI: http://doi.org/10.1097/ICO.0b013e31802eaee6
- Reed L., Muench H. A simple method of estimating 50% endpoints. Amer. J. Hygiene. 1938; 27: 493-7.
- Миронов А.Н., Бунатян Н.Д., Васильев А.Н., Верстакова О.Л., Журавлёва М.В., Лепахин В.К. и др. Руководство по проведению доклинических исследований лекарственных средств. Часть 1. М.: Гриф и К; 2012.
- Osano E., Kishi J., Takahashi Y. Phagocytosis of titanium particles and necrosis in TNF-alpha-resistant mouse sarcoma L929 cells. Toxicol. In Vitro. 2003; 17(1): 41-7. DOI: http://doi.org/10.1016/s0887-2333(02)00127-3
- Cotarelo M., Catalan P., Sanchez-Carrillo C., Menasalvas A., Cer-cenado E., Tenorio A., et al. Cytopathic effect inhibition assay for determining the in vitro susceptibility of herpes simplex virus to antiviral agents. J. Antimicrob. Chemother 1999; 44(5): 705-8. DOI: http://doi.org/10.1093/jac/44.5.705
- Gain P., Jullienne R., He Z., Aldossary M., Acquart S., Cognasse F., et al. Global survey of corneal transplantation and eye banking. JAMA Ophthalmol. 2016; 134(2): 167-73. DOI: http://doi.org/10.1001/jamaophthalmol.2015.4776
- Williams K.A., Muehlberg S.M., Lewis R.F., Coster D.J. How successful is corneal transplantation? A report from the Australian Corneal Graft Register. Eye (Lond). 1995; 9(Pt. 2): 219-27. DOI: http://doi.org/10.1038/eye.1995.43
- Kaye R., Steger B., Chen J.Y., Romano V. A serious adverse surgical event: Management of suspected HSV-1 keratitis in a donor cornea. Spektrum Augenheilkd. 2017; 31(1): 19-22. DOI: http://doi.org/10.1007/s00717-016-0325-6
- Wilhelmus K.R. Antiviral treatment and other therapeutic interventions for herpes simplex virus epithelial keratitis. Cochrane Database Syst. Rev. 2015; 1: CD002898. DOI: http://doi.org/10.1002/14651858.CD002898.pub5
Дополнительные файлы